近期有關肺癌的研究進展一覽
時間:2017-06-27 09:27:23 來源:生物谷 點擊:
本期為大家?guī)淼氖欠伟┑陌l(fā)生、診斷與治療領域相關的最新研究進展,希望讀者朋友們能夠喜歡。





doi: 10.1172/JCI87724

基因p53在正常情況下能夠作為一種腫瘤抑制子,但當其發(fā)生突變時就會參與近乎一半人類癌癥的發(fā)生和發(fā)展;近日,來自弗吉尼亞聯邦大學Massey癌癥研究中心的研究人員通過研究揭示了肺癌細胞依賴于突變p53而發(fā)展的分子機制,相關研究或為后期開發(fā)新型有效的肺癌療法提供新的思路和希望。
每年,肺癌都會引發(fā)很多癌癥患者死亡,其中包括結腸癌、乳腺癌、前列腺癌等,據美國癌癥協(xié)會數據顯示,2017年在美國將會有超過22萬新發(fā)的肺癌患者,當然這需要研究人員快速開發(fā)出新型有效的療法來予以應對。這項研究中,研究人員揭示了一種新型策略,通過阻斷名為ChK1的監(jiān)督蛋白的功能來抑制小鼠模型和培養(yǎng)中細胞系的肺癌的發(fā)展,蛋白質ChK1能夠增加基因組復制的成功性。
研究者Deb說道,某些突變的p53不僅會放松腫瘤抑制的功能,還會或許致癌功能,這項研究中我們首次闡明了一種機制,即癌細胞如何依賴獲取p53基因的突變功能來得以生存和生長,基于相關的研究結果,我們或許就能夠開發(fā)出新型療法來殺滅攜帶突變p53的肺癌細胞,同時還并不會損傷健康組織。
本文研究的關鍵就是在細胞生長過程中基因組的復制,所有細胞都會通過這一過程來進行DNA復制以及細胞分裂,而且循環(huán)中的每一個階段對于細胞基因組復制、細胞分裂等關鍵過程都非常重要。通過研究癌細胞的基因組,研究人員就發(fā)現,突變的p53基因能夠產生過量的ChK1和細胞周期蛋白A蛋白,這些蛋白能夠幫助調節(jié)細胞周期的進展和ChK1的功能,尤其是能夠幫助抑制復制叉的"崩塌";在細胞分裂之前,我們的基因組必須從預先設定好的復制起點來進行復制從而制造子代細胞的拷貝;新復制的DNA會沿著親本基因組的復制叉開始進行復制,而且多個監(jiān)督蛋白(比如ChK1)在DNA復制完成之前還能夠抑制新形成的復制叉"崩塌",當復制叉"崩塌"時,細胞分類就不會完成,而且細胞會死亡。
抑制ChK1蛋白往往被用來抑制癌細胞的生長,然而其目前在臨床試驗中很少有成功的案例,本文研究結果表明,ChK1抑制子或許能夠有效阻斷獲取突變p53功能的患者機體中癌細胞的繁殖,因此,ChK1抑制子目前或許還并不能夠用于合適的癌癥群體。最后研究者Deb表示,下一步我們計劃開發(fā)新型策略,利用本文的研究發(fā)現來阻斷攜帶突變p53的肺癌的擴散,由于p53在很多種癌癥中都會發(fā)生突變,因此本文研究或能夠幫助指導多種不同類型癌癥患者的治療。
doi:10.1038/ng.3892

近日,一項刊登在國際雜志Nature Genetics上的研究報告中,來自多倫多大學等機構的研究人員進行了一項大型的全基因組關聯性研究,他們利用多個癌癥研究機構所開發(fā)的基因分型平臺鑒別出了肺癌的新型易感性位點。
盡管吸煙是引發(fā)肺癌的主要風險因子,但過去研究結果表明,肺癌的遺傳性或許占到了18%;當然此前的全基因組關聯性研究中,研究人員也鑒別出了多個肺癌易感位點,但研究者對于大部分疾病遺傳性都無法解釋,本文研究中研究人員就在該項研究上取得了重大突破。
這項研究中,研究人員對有現有數據的歐洲個體進行研究(包括14803名研究對象和12262名對照個體),最終他們鑒別出了18個疾病易感位點,其中包括10個新型位點;這些新型位點能夠揭示出肺腺癌和鱗狀肺癌兩種肺癌亞型之間風險模式的驚人變化,其中4個位點和總體的肺癌相關,6個位點和肺腺癌直接相關,研究者還發(fā)現,和端粒功能相關的多個基因的突變或許在誘發(fā)肺腺癌風險上扮演著關鍵角色(并非鱗狀肺癌風險)。
研究者Amos說道,讓我們非常激動的是這項研究的規(guī)模以及所發(fā)現的影響肺癌風險的基因都是此前其他研究人員并未報道過的;本文研究或能幫助我們闡明影響肺癌風險的新機制;尤其是研究人員鑒別出了多個影響細胞端粒功能的新型突變,這些突變能夠直接影響肺腺癌的風險。
此外,研究者還發(fā)現,影響肺癌風險的煙堿性受體亞單位周圍的突變以及吸煙似乎會對機體小腦產生一定的影響,研究人員很少發(fā)現小腦能夠參與影響機體的成癮行為;后期研究人員還需要進行更為深入的研究來理解靶向基因在影響肺癌風險、吸煙行為和吸煙效應上所扮演的角色。

對III期CONVERT臨床試驗進行的后期亞分析(subanalysis)證實白細胞增強藥物(blood cell boosting drug)在小細胞癌(small cell lung cancer, SCLC)同步化放療期間是安全的。相關亞分析結果發(fā)表在歐洲肺癌會議(European Lung Cancer Conference, ELCC)上。
英國克里斯蒂國家醫(yī)療服務系統(tǒng)基金會(Christie NHS Foundation Trust)腫瘤內科醫(yī)生Fabio Gomes博士說,"對局限期SCLC的最佳治療是同步化放療。這種強化治療的療效伴隨著更大的毒性(主要是在血液、食管和肺部中發(fā)生的)。這意味著這種療法并不適合每名病人,而且更多的病人將努力按照計劃開展治療。"
粒細胞集落刺激因子(G-CSF)經常作為一種支持性措施被用來促進中性粒細胞存活、增殖和分化。預期的中性粒細胞減少并不那么嚴重,而且病人更快地恢復,從而降低他們的傳染性并發(fā)癥風險。然而,在SCLC同步化放療期間,它的使用是存在爭議的,而且美國臨床腫瘤學會(American Society of Clinical Oncology, ASCO)并不推薦經常使用它。這是因為在1989年到1991年期間針對215名符合條件的病人開展的一項隨機臨床試驗已表明在同步化放療期間,當使用粒細胞-巨噬細胞集落刺激因子(GM-CSF)時,發(fā)生的重度血小板減少、嚴重貧血、肺部并發(fā)癥和中毒死亡顯著增加。
Gomes說,"自從這項可能影響集落刺激因子在這種情形下使用安全性的臨床試驗在1995年發(fā)布以來,兩個重大的變化發(fā)生了。首先,這項臨床試驗是針對GM-CSF進行測試的。GM-CSF作用于一種以上的血細胞譜系,而且如今是不常使用的。其次,自從那時以來,現代的放療技術進展迅速,變得更加精準,這會降低中毒風險。"
這項III期CONVERT臨床試驗招募了547名局限期SCLC病人,這些病人接受同步化放療,隨機地接受每日一次或每日兩次的放療。這兩個病人組在總生存期上并不存在差異。
這項臨床試驗允許使用G-CSF,而且在這種治療的某個時間點上,大約40%的病人接受它的使用。對如今在在歐洲肺癌會議上發(fā)表的分析結果,這些研究人員比較了在同步放化療期間接受G-CSF使用的病人和不接受G-CSF使用的病人的中毒情形和治療結果。
他們證實在治療期間接受G-CSF使用的病人當中,重度血小板減少和嚴重貧血的發(fā)生幾率幾乎增加一倍,分別為30%和20%,然而,這些幾率低于之前報道的情形。這隨后顯著高地采用進一步的支持性措施,如血小板和輸血。然而,在肺部并發(fā)癥或生存期上,并不存在差別。
Gomes說,"G-CSF并沒有對這些病人的治療結果產生顯著的負面影響,這是非常令人欣慰的。在整個治療期間,一種適當的支持性措施可平衡更高的血液中毒。"
他繼續(xù)說道,"我們從這種分析中作出結論:在胸部放療期間,使用G-CSF是安全的,而且應當促進病人接受計劃的同步化放療完整療程,實現盡可能最好的益處。當在這種情形下有需要時,這些發(fā)現應當讓臨床醫(yī)生有信心使用G-CSF。我們旨在在今年晚些時候發(fā)布完整的分析結果,這可能希望有助于改變當前的指導方針。"
對這些發(fā)現進行評論時,瑞士HFR-H?pital Cantonal 醫(yī)學腫瘤科高級顧問 Stefan Zimmermann 博士說,"腫瘤醫(yī)師確實需要G-CSF來緩解中性粒細胞減少,增加化療運送和依從性,但是及時采取的同步治療的有益效果超過了中毒風險。"
他繼續(xù)說道,"在這種研究中,使用G-CSF并不導致肺炎風險增加,但是重度血小板減少的發(fā)生率是令人擔憂的。使用G-CSF有利于無進展生存期和總生存期。我們能夠作出結論,利用G-CSF對發(fā)熱性中性粒細胞減少進行一次或二級預防是合理的,但是具有更高血小板減少風險的病人應該謹慎地接受治療。"
doi:10.1172/JCI89548

細胞不斷地利用分子開關(磷酸分子)開啟和關閉蛋白表達,也因此,這種分子開關成為常見的藥物靶標。在一項新的研究中,研究人員發(fā)現利用一種新的小分子直接激活一種腫瘤抑制蛋白可阻止小鼠中的肺癌生長。相關研究結果于2017年5月15日發(fā)表在Journal of Clinical Investigation期刊上,論文標題為"Activation of tumor suppressor protein PP2A inhibits KRAS-driven tumor growth"。
美國凱斯西儲大學的GouthamNarla博士說,"我們當前擁有的治療我們的癌癥患者的所有藥物都是靶向激酶,即將磷酸分子附著到蛋白上的酶。但是,與這同樣重要的是,還存在移除磷酸分子的酶(即磷酸酶)。"
一種被稱作PP2A的磷酸酶能夠通過移除附著到腫瘤蛋白上的磷酸分子來關閉它們的表達。但是,根據Narla博士的說法,"這種腫瘤抑制蛋白的表達在幾乎每種主要的癌癥中都被關閉。它的失活是一種正常的細胞變成癌細胞所必不可少的。"
Narla和他的團隊決定采取一種非常規(guī)的癌癥藥物開發(fā)方法:尋找直接靶向PP2A的分子以便重新激活它的腫瘤抑制性質。
54名研究人員合作篩選了一系列藥物類似的分子是否能夠重新激活肺癌細胞中的PP2A和阻止小鼠體內的肺癌腫瘤生長。
這些研究人員發(fā)現一種特定的原型藥物能夠附著到PP2A蛋白的一個亞基上,有效地激活這種酶。正如Narla博士所解釋的那樣,這項研究是首次利用一種小分子直接激活一種移除磷酸分子的酶。
在實驗室模型(包括臨床前肺癌細胞模型和小鼠模型)中,這種原型藥物也阻止肺癌細胞增殖。接受這種原型藥物注射的小鼠具有更少的肺癌腫瘤,而且也不會經歷體重減少或與其他癌癥藥物相關的行為異常。在小鼠模型中,這種原型藥物的療效可與當前用來延緩肺癌進展的組合藥物不相上下。
為了證實這種原型藥物在哪兒結合到PP2A上,這些研究人員也培育出在假定的藥物結合位點發(fā)生特定突變的肺癌細胞。患上由這些突變的肺癌細胞產生的腫瘤的小鼠并不受益于這種原型藥物,這是因為這種原型藥物不能夠結合和重新激活PP2A。
Narla注意到,"大約有2000多篇論文探究了PP2A在癌癥中的作用。在乳腺癌、前列腺癌、肺癌、腦癌、兒童癌癥、卵巢癌和子宮內膜癌中,每種主要的癌癥都涉及這種蛋白的失活。允許我們激活它表達的分子有潛力在一系列癌癥患者體內發(fā)揮作用。"
Narla補充道,"我們正在一系列的動物模型中測試我們的原型藥物。如果事情繼續(xù)進展良好,那么我們希望在下一年利用這種原型藥物開展臨床試驗。我們的初步臨床試驗將會是比較廣泛的,將會涵蓋許多不同類型的癌癥患者,包括肺癌患者。"
這項研究是在臨床前肺癌細胞模型和小鼠模型中開展的,所獲得的研究結果可能不一定適用于人肺癌。再者,小鼠接受肺癌腫瘤移植,而不是它們自己產生這種腫瘤,而且它們接受這種原型藥物治療僅四周的時間。這種原型藥物的長期治療效果仍然是未知的。
doi:10.1038/nature22334

肺腺癌是一種侵襲性肺癌,大約占美國肺癌病例的40%。據認為,它是由良性的肺腺瘤產生的。
如今,在一項新的研究中,來自美國麻省理工學院的研究人員在肺癌進化中鑒定出一個重大的分子開關。當肺癌模式小鼠體內的肺腺瘤轉化為肺腺癌時,這個開關會處于開啟狀態(tài)。他們也發(fā)現阻斷這個開關會阻止肺腺瘤變得更具侵襲性。他們說,因此,干擾這個開關的藥物可能適合用于治療早期肺癌。相關研究結果于2017年5月10日在線發(fā)表在Nature期刊上,論文標題為"A Wnt-producing niche drives proliferative potential and progression in lung adenocarcinoma"。
論文通信作者、麻省理工學院科赫綜合癌癥研究所主任Tyler Jacks說,"當腫瘤由良性狀態(tài)轉化到惡性狀態(tài)時,理解激活的分子通路對治療產生重要的影響。這些發(fā)現也有助開發(fā)阻止或干擾晚期疾病產生的方法。"
當肺腺瘤中的一小部分細胞開始變得像干細胞時,這個開關就處于開啟狀態(tài),從而允許它們無限制地產生新的癌細胞群體。
論文第一作者、麻省理工學院科赫綜合癌癥研究所博士后研究員TuomasTammela說,"它看來好像是這些干細胞是腫瘤生長的發(fā)動機。它們被賦予非常強健的增殖潛力,它們產生其他的癌細胞,而且也產生更多的干細胞樣細胞(stem-like cell)。"
腫瘤干細胞
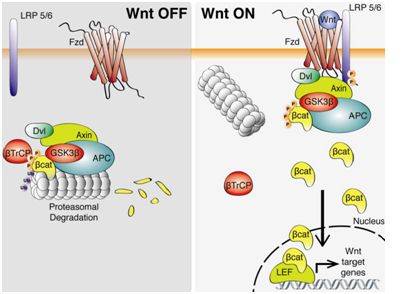
在這項研究中,這些研究人員發(fā)現著重關注一種被稱作Wnt的細胞信號通路的作用。這個通路通常在胚胎發(fā)育期間處于活性狀態(tài),不過它在一小群成體干細胞(能夠產生特定的組織,如腸道內壁)中也是有活性的。
Wnt通路的一個重大作用是維持細胞處于干細胞樣狀態(tài),因此這些研究人員猜測Wnt可能參與早期肺腺瘤變成肺腺癌時發(fā)生的快速增殖。
這些研究人員以經過基因改造患上肺腺瘤的小鼠為研究對象探究了這個問題。這些小鼠通常會進展到肺腺癌。在這些小鼠體內,他們發(fā)現Wnt信號在肺腺瘤中是沒有活性的,但是在這個轉化期間,大約5%~10%的肺腺瘤細胞會激活Wnt通路。這些細胞隨后會無限制地產生新的癌細胞。
此外,大約30%~40%的肺腺瘤細胞開始產生構建一種"微環(huán)境(niche)"的化學信號。這種微環(huán)境是維持細胞處于干細胞樣狀態(tài)所必需的一種局部環(huán)境。
Tammela說,"如果你從這種微環(huán)境中取出干細胞,那么它快速地喪失這種干性(stem-ness)。你具有一種形成這種微環(huán)境的細胞類型,你然后才具有另一種接受這種微環(huán)境信號并且表現得像干細胞那樣的細胞類型。"
盡管在一些其他的癌癥(包括結腸癌)中,已發(fā)現Wnt促進腫瘤形成,但是這項研究指出它在肺癌、可能在胰腺癌等其他癌癥中發(fā)揮著一種新的作用。
Tammela說,"這一發(fā)現的新穎之處在于這個通路不是腫瘤促進物,但是它修飾這些癌細胞的特征。它定性地改變癌細胞的表現方式。"
靶向Wnt
當這些研究人員讓這些小鼠服用一種干擾Wnt蛋白的藥物(一種Wnt抑制劑)時,他們發(fā)現它們的肺腺瘤停止生長,而且它們的生存期增加了50%。再者,當這些經過治療的腫瘤細胞移植到另一種動物體內時,它們都不能夠產生新的腫瘤。
這些研究人員也分析了人肺腺癌樣品,結果發(fā)現70%的樣品存在Wnt激活,而且80%的樣品具有激活Wnt活性的微環(huán)境細胞。他們說,這些發(fā)現提示著在早期肺癌病人體內測試Wnt抑制劑可能是值得的。
這些研究人員也正在開發(fā)以更加靶向的方式運送Wnt抑制劑的方法以便避免這些藥物帶來的一些副作用。另一種可能避免副作用的方法是開發(fā)更加特異性的僅靶向在肺腺癌中有活性的Wnt蛋白的抑制劑。他們在這項研究中使用的這種抑制劑靶向所有的19種Wnt蛋白,而且它如今用于治療其他癌癥的臨床試驗中。
doi: 10.1016/j.celrep.2017.03.042

日前,一項刊登在國際雜志Cell Reports上的研究報告中,來自賓夕法尼亞大學的研究人員通過研究發(fā)現,在前列腺癌小鼠模型中新鑒別出的一種分子鏈或許提供了治療前列腺癌及其它癌癥的新型靶點。
研究者表示,蛋白質PKCε的過表達以及腫瘤抑制自Pten的缺失或許會誘發(fā)前列腺癌的進展,這種致死性的組合往往會誘發(fā)促癌分子CXCL13水平的升高,當研究者特意阻斷CXCL13或CXCL5的表達時,其所吸附的細胞表面受體、小鼠前列腺癌細胞的轉移以及腫瘤形成特性就會被損傷。
研究者Kazanietz說道,本文研究除了能夠提供證據來揭示PKCε所誘發(fā)的癌癥惡性循環(huán)外,本文研究還發(fā)現阻斷CXCL13-CXCL5分子或許就能夠幫助開發(fā)一種新型的癌癥療法;研究者計劃鑒別新型化合物來阻斷CXCL13或CXCL5分子,從而幫助開發(fā)潛在的抗癌之際,同時研究者還發(fā)現,血液中CXCL13分子的水平或許能夠用作一種生物標志物來幫助測定患者機體中前列腺癌進展的精確狀態(tài)。
下一步研究者將會通過深入研究闡明如何干擾來自癌細胞以及腫瘤微環(huán)境附近細胞的CXCR5/CXCL13,腫瘤微環(huán)境附近也會誘發(fā)癌癥生長和發(fā)展。如今胸肺科醫(yī)生和腫瘤學家都發(fā)現肺癌患者機體中PKCε蛋白會進行過表達,但他們并不理解確切的分子事件結果,一般而言,較高水平的PKCε蛋白往往和患者預后較差直接相關。
最后研究者Kazanietz說道,基于本文研究結果我們在肺癌領域研究或許取得了新的發(fā)現,后期我們還將會進行深入的聯合研究來開發(fā)治療前列腺癌和肺癌的新型療法或藥物制劑。
DOI: 10.1158/0008-5472.CAN-16-3072

對于發(fā)生ALK重排的非小細胞肺癌患者來說, 他們對crizotinib這種藥物的臨床應答持續(xù)時間和藥物作用強度都不可預測,幾乎所有病人最終都會產生抵抗。
在一項新研究中,來自法國的研究人員評估了存在異常ALK-FISH模式的循環(huán)腫瘤細胞是否能夠預測接受crizotinib治療的ALK重排病人的無進展生存時間。相關研究結果發(fā)表在國際學術期刊Cancer Research上。
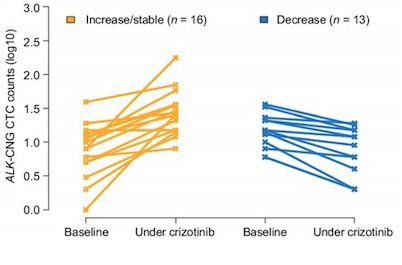
在這項研究中,研究人員將39名存在ALK重排的非小細胞肺癌病人納入研究隊列,這些病人接受crizotinib治療用以作為ALK抑制劑。研究人員收集了基線和crizotinib治療兩月以后的病人血液樣本,利用免疫熒光染色結合過濾濃縮的方法,在循環(huán)腫瘤細胞中檢測了異常的ALK-FISH模式。
研究人員根據ALK重排情況以及ALK-CNG信號將循環(huán)腫瘤細胞歸類成不同的亞群。他們發(fā)現ALK重排或ALK-CNG循環(huán)腫瘤細胞的基線數目與無進展生存時間并無顯著性關聯。但是他們觀察到接受crizotinib治療之后ALK-CNG循環(huán)腫瘤細胞數目的減少與更長的無進展生存時間存在顯著關聯性。
研究人員還通過多變量分析發(fā)現ALK-CNG循環(huán)腫瘤細胞的動態(tài)改變是與無進展生存時間有關的最強因素。有研究表明ALK-CNG是腫瘤對crizotinib獲得抵抗的重要機制之一。
這項研究的結果表明ALK-CNG循環(huán)腫瘤細胞數目的動態(tài)變化可能是一個具有預測作用的生物標記物,可用以評估crizotinib對ALK重排非小細胞肺癌病人的治療效果。對循環(huán)腫瘤細胞進行的系列分子分析表明未來有望實現對病人進行實時監(jiān)控以及對病人進行臨床結果預測。

近日,在歐洲肺癌大會(ELCC)上報道的一項研究顯示,白細胞計數可以用來預測肺癌患者是否會從免疫治療中獲益。ELCC 是歐洲肺癌領域醫(yī)學專業(yè)人員的重要科學交流學術會議。它由歐洲醫(yī)學腫瘤學會(ESMO)和國際肺癌研究協(xié)會 (IASLC) 組織。ELCC 提供了對胸部惡性腫瘤最新知識的全面多學科概述,涵蓋了預防、篩查、診斷、治療方式等各個方面,以及基礎、臨床和轉化研究的結果,由國際頂尖專家參加且作報告介紹。
該研究主要作者、意大利帕爾馬大學醫(yī)院(University Hospital of Parma)DMT 胸腫瘤外科 Marcello Tiseo 博士說:"免疫檢查點抑制劑,如 nivolumab 單抗和 pembrolizumab 單抗,顯著提高非小細胞肺癌(NSCLC)患者的總體生存率。研究人員正在尋找一種預測性生物標志物來選擇將受益于這種治療的患者,以避免對部分不反應患者產生不必要的藥物毒性和資源浪費。"
他繼續(xù)說道:"腫瘤組織活檢中的 PD-L1 表達量被用于選擇適當的患者,但該方案不完全準確,可能是因為它不能反映出動態(tài)的免疫反應。血液中的生物標志物更容易獲得,可能是更好的免疫反應指標。"
本研究評估了白細胞計數能否預測肺癌患者是否對 nivolumab 單抗治療有反應。該研究涉及了 54 名 NSCLC 患者,每 14 天接受一次劑量為 3mg/kg 的 nivolumab。白細胞計數在基線水平,第二次 nivolumab 療程循環(huán)后和第四次 nivolumab 循環(huán)后進行。研究人員比較了針對 nivolumab 應答者與非應答者的白細胞計數,他們發(fā)現,在基線和治療期間,白細胞計數可以預測患者是否會對 nivolumab 單抗治療作出反應。在基線水平時,應答者體內天然殺傷細胞的數量和濃度增高,治療期間天然殺傷細胞數量也有所增加。對 nivolumab 單抗有反應的患者也具有更多數目和更高濃度的 CD8 陽性 T 細胞,它們表達 PD-1。
Marcello Tiseo 博士說:"自然殺傷細胞的數量和功能以及 CD8 陽性 T 細胞中 PD- 1 表達的頻率可能是晚期 NSCLC 中 nivolumab 治療的預測生物標志物。鑒定出一組血液預測生物標志物將能夠早期確定最有可能受益于抗 PD- 1 和抗 PD-L1 治療的患者。"
瑞士 HFR - H?pital Cantonal 醫(yī)學腫瘤科的高級顧問 Stefan Zimmermann 博士在評論該發(fā)現時表示:"在目前精準醫(yī)學的時代,我們迫切需要適當的預測性生物標志物來選擇將會受益于特定治療的患者。這項研究發(fā)現,某些白細胞的基線水平確實在預測肺癌患者的免疫治療反應中起作用。我們應該在未來的臨床試驗中研究這些新因素,連同腫瘤 PD-L1 表達量和構成癌癥免疫圖譜的其他標志物一起,預測患者是否能從治療中受益。"
doi:10.1016/j.cell.2017.04.014

免疫療法已在晚期肺癌患者中取得顯著的療效。如今,在一項新的研究中,來自美國西奈山伊坎醫(yī)學院(Icahn School of Medicine at Mount Sinai)等研究機構的研究人員發(fā)現免疫療法在治療新確診的肺癌患者中也有巨大的希望,在這種致命性的疾病有機會站穩(wěn)腳跟之前阻止它,從而提供一種潛在的治愈方法。相關研究結果發(fā)表在2017年5月4日的Cell期刊上,論文標題為"Innate Immune Landscape in Early Lung Adenocarcinoma by Paired Single-Cell Analyses"。
西奈山伊坎醫(yī)學院蒂施癌癥研究所(Tisch Cancer Institute)的研究人員發(fā)現在允許免疫療法讓一些晚期肺癌患者病情好轉的免疫細胞當中,一些相同的免疫細胞在這種疾病剛站穩(wěn)腳跟時也是存在的。論文通信作者、蒂施癌癥研究所腫瘤科學教授、主任醫(yī)師(血液學與內科腫瘤學)Miriam Merad博士說,在此之前,人們對早期肺癌中的免疫反應知之甚少。
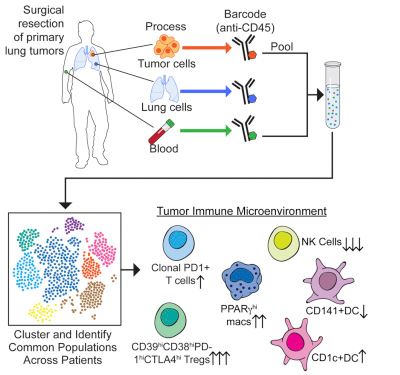
當肺癌患者接受外科手術移除癌變病灶時,Merad博士及其團隊獲得這些患者的肺瘤樣品、周圍的健康肺組織樣品以及血液樣品,并且立即在細胞水平上分析這些樣品,從而繪制存在的免疫系統(tǒng)組分圖譜。
Merad團隊設計出一種條形碼方法:給每個樣品中的細胞附著一種不同的金屬同位素,從而允許將這些樣品匯集在一起以便對來自這三種組織類型的細胞同時進行分析。他們將這種條形碼方法與多尺度免疫分析(multiscale immune profiling)結合在一起,從而繪制出完整的免疫細胞圖譜,以便尋找腫瘤驅動的變化。這些變化將容易受到靶向免疫療法的影響。
對這些樣品的分析結果表明I期肺癌病灶已存在免疫系統(tǒng)組分,這些組分可能破壞抗腫瘤T細胞抵抗癌癥的能力。這些單細胞分析結果史無前例地詳細揭示出腫瘤驅動的免疫變化,從而提供一種強大的工具在未來開發(fā)新的免疫療法,如免疫檢查點抑制劑,特別是那些靶向讓癌癥免受免疫系統(tǒng)傷害的PD-1和PD-L1蛋白的免疫檢查點抑制劑;經證實這些免疫檢查點抑制劑在治療晚期癌癥中已表現出巨大的希望。
Merad博士說,"免疫療法主要用于治療晚期或轉移性肺癌,但是它在治療早期腫瘤中的益處仍是未知的。早期肺癌的標準治療通常是利用外科手術切除病灶,有時還伴隨著化療和放療。我們的研究揭示出早期肺部病灶大量地浸潤著很多不同的免疫細胞,這提示著免疫療法也可能用于治療極其早期的病灶,并且潛在地開發(fā)出一種治愈方法,從而在癌癥真正地在肺部站穩(wěn)腳跟之前阻止它。"
這項新的研究還鑒定出許多額外的免疫治療靶標,從而增加顯著受益于免疫療法的患者人數。就目前而言,這些受益于免疫療法的患者的人數仍然比較少。當前,這項研究正被用于開展針對早期肺癌患者的免疫療法臨床試驗。
Merad博士說,"大約50%的小細胞肺癌病灶患者會復發(fā)。當肺癌進入晚期時,化療并沒有很大的成功率,因此知道如何攻擊早期的肺癌可能對復發(fā)的病人數量和他們的總生存期產生重大的影響。我們的研究進一步證實了免疫治療試劑在治療早期癌癥上是最為高效的,特別是對從未接受化療的患者而言。
doi:10.1038/ncomms14922.

日前,一項刊登在國際雜志Nature Communications上的研究研究報告中,來自肯塔基大學的研究人員通過研究發(fā)現,在特定的遺傳狀況下,一種非小細胞肺癌或許或轉變成為另外一種肺癌亞型。
肺癌的譜系開關會對一些癌癥療法產生耐藥性,這項研究中,研究人員具體檢測了這種譜系開關發(fā)生的機制。此前研究中,研究人員并不清楚成年人肺部中哪種細胞是引發(fā)非小細胞肺癌兩種主要亞型的細胞起源,這兩種主要的肺癌亞型分別為腺癌和鱗狀細胞癌;同樣地,研究人員也并不清楚這種不同肺癌亞型之間DNA組裝的差異所在。肺部腺癌的存在在臨床上被定義為所有腺癌病變都存在,而且相同的腫瘤中會出現鱗狀損傷的明顯分層,這就表明,肺腺癌和鱗狀細胞癌或許來自于肺部組織中相同的細胞,但目前研究人員缺乏明確的證據來對此進行證實。
這項研究中,研究者發(fā)現,肺腺癌細胞能夠以特殊的方式對DNA進行重新組裝來轉化成為肺部鱗狀細胞癌,通過對腺癌肺部腫瘤的小鼠模型進行研究,研究人員將其同人類腺癌肺部腫瘤進行了對比證實了這種遺傳性所在,人類的腺癌肺部腫瘤同小鼠在遺傳性上相同,其中包括癌基因KRAS的激活以及腫瘤抑制自Lkb1的剔除;隨后研究人員進行移植試驗發(fā)現,在小鼠機體中,已經建立的肺部腺癌腫瘤能夠過渡成為肺部鱗狀細胞癌。
隨后研究人員分離到了不同的肺部細胞,研究表明,僅有特定的肺部細胞能夠產生具有譜系開關特性的肺部腫瘤。研究者Christine Fillmore Brainson教授表示,本文研究數據讓我們非常激動,我們發(fā)現肺部組織中的細胞能夠產生腺癌腫瘤,同時我們所利用的轉化分離細胞的技術也能夠應用于多種肺癌魔性的深入研究中。當EGFR酪氨酸激酶抑制劑療法失敗后,很多腫瘤學家觀察到了譜系開關的存在,這種療法在臨床上往往會進行第二活檢,然而通常在化療后第二活檢往往無法進行,研究者認為這種實踐或許能夠修訂我們對化療耐受性具體機制的理解。
最后研究者Brainson指出,如今我們闡明了譜系開關的分子機制,我們也將開始深入探究如何操控這種機制來開發(fā)出治療肺癌的新型個體化療法。





